DEMONSTRATIA CINETICA A ECHILIBRULUI
CHIMIC
Se considera o reactie reversibila de forma
generala:
v1
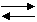 A + B C + D (4.1)
A + B C + D (4.1)
v2
in care, pentru reactia directa, substantele A si B
sunt reactantii, iar C si D produsii, iar pentru reactia
inversa, substantele C si D sunt reactantii, iar A si
B produsii. Cele doua reactii au loc simultan.
Daca se noteaza concentratiile molare (exprimate prin
moli/litru solutie) cu [A], [B], [C] si [D], vitezele v1
si v2 ale celor doua reactii sunt date de
relatiile:
v1
= k1[A][B] (4.2)
v2
= k2[C D] (4.3)
Constantele de proportionalitate k1 si k2 se numesc constante
de viteza ale reactiilor respective si ele depind de natura
substantelor ce reactioneaza. Deoarece, la echilibru, viteza
reactiei directe este egala cu viteza
reactiei inverse:
v1
= v2 (4.4)
rezulta
k1[A][B] = k2[C][D] (4.5)
de unde:
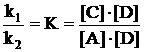 (4.6)
(4.6)
Constanta K se numeste constanta de echilibru.
Atunci cand concentratiile substantelor sunt 1 molare,
constantele de viteza sunt egale cu vitezele de reactie, iar constanta
de echilibru este egala cu raportul celor doua viteze de
reactie.


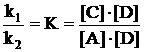 (4.6)
(4.6)