Studiul termodinamic al reactiei dioxidului de seleniu cu
carbonul cu formare de seleniu si manoxid de carbon
CUPRINS
CAPITOLUL 1 Notiuni
introductive
CAPITOLUL
2. Transformarea temperaturilor de topire si fierbere
ale substantelor principale in toate scarile termodinamice.
CAPITOLUL
3. Entalpia
de reactie:
-calculul
entalpiei de reactie in conditi standard
-aprecieri
asupra stabilitatii compusilor obtinuti in comparatie
cu alti compusi similari.
-determinarea dependentei entalpiei de reactie
in functie de temperatura
-particularizarea si trasarea grafica a dependentei entalpiei la temperatura de 330,
530, 730, 930K pentru un mol de substanta principala, respectiv 200 kg subsanta
principala.
CAPITOLUL
4. Entropia
de reactie:
-calculul entropiei de reactie
-aprecieri calitative asupra entropiei de reactie
-determinarea dependentei entropiei de reactie in
functie de temperatura
-particularizarea si trasarea grafica a dependentei entropiei la temperatura de 330,
530, 730, 930K pentru un mol de substanta principala, respectiv 200 kg subsanta
principala.
CAPITOLUL
5. Energia libera Gibbs:
-calculul energiei libere Gibbs in conditi standard
-aprecieri asupra spontaneitatii procesului
-determinarea dependentei energiei libere Gibbs
in functie de temperatura
-particularizarea si trasarea grafica a dependentei energiei Gibbs la temperatura
de 330, 530, 730, 930K pentru un mol de substanta principala, respectiv 200 kg
subsanta principala.
CAPITOLUL
6. Afinitatea
de reactie
CAPITOLUL
7. Concluzii
CAPITOLUL
8. Bibliografie
CAPITOLUL 1. NOTIUNI INTRODUCTIVE
Termodinamica
studiaza fenomenele termice folosind marimi ce pot fi masurate direct
(presiunea, volum, temperature) sau care pot fi calculate cu ajutorul altor
marimi ce pot fi stabilite pe cale experimentala.
Termodinamica opereaza cu o serie de notiuni si
marimi , cu ajutorul carora se defineste
orice process sau fenomen termic. Una dintre acestea este notiunea de sistem
temodinamic.
Sistemul temodinamic reprezinta un sistem fizic
macroscopic ale carui dimenisiuni spatiale si existenta in timp permit
efectuarea unor procese normale de masurare.
Carbonul
Este un element remarcabil din
mai multe motive: printre formele sale diferite se afla una dintre cele mai moi
(grafit) si una dintre cele mai dure(diamant).
Este unic
prin proprietatile sale chimice pentru ca formeaza cel mai mare grup de
combinatii, in special cu hidrogenul (compusi organici). Toate plantele si
animalele sunt formate din combinatii complexe organice unde carbonul e
combinat cu oxigenul, hidrogenul, azotul si alte elemente.
Carbonul este in general sigur, dar poate lua foc
la temperaturi inalte si poate arde puternic (ca in accidental nuclear din
Windscale, Marea Britanie, 10 octombrie 1957).
Seleniu
Este un microelement antioxidant si se presupune
si anticancerigen. In organism contribuie la realizarea respiratiei celulare, la
protejarea hemoglobinei celulelor rosii, ca si la absorbtia si sporirea
eficientei vitaminei E.
In cantitati mici se gaseste in diferite
produse(mai ales de origine vegetala), ca de exemplu:ceapa, rosii, germeni de
grau etc.
Excesul de selenium poate duce la orbire, paralizarea
muschilor si tulburari respiratorii. Se foloseste in celule fotoelectrice, camere
de filmat, la redresarea curentului electric, copiatoare etc.
Seleniul
pur isi creste conductivitatea de o mie de ori cand este mutat de la intuneric
la lumina solara puternica, lucru care il face utilizat la construirea
luxumetrelor.
Monoxidul
de carbon
Este o combinatie intre un
atom de carbon si un atom de oxigen.
Este un gaz asfixiant, toxic, incolor si indoor, care
ia nastere printr-o ardere(oxidare) incomplete a substantelor care contin
carbon.
Acest
proces are loc in cazul arderii la temperaturi inalte intr-un loc sarac in
oxygen, formandu-se monoxide de carbon in locul dioxidului. Este un gaz
inflamabil care arde cu flacara albastra,
este otravitor.
Monoxidul de carbon este utilizat in metalurgie
unde reactioneaza cu oxizii de fier; o parte din acesta ajunge in aer unde
actioneaza ca poluant
Efectul
toxic asupra organismului e determinat de reactia monoxidului de carbon cu
hemoglobina din sange.
DATE NECESARE STUDIULUI
TERMODINAMIC
Reactia
studiata este:
SeO2(s) + 2C(s)→Se(s)+2CO(g)
In
tabel sunt prezentate datele termodinamice necesare calculului:
Tabel 1.
Date termodinamice
|
substanta
|
∆H°f, 298
[kcal/mol]
|
S°f, 298
[cal/mol·k]
|
C°P=f(T)
[cal/mol·k]
|
∆T
[k]
|
|
a
|
b·10³
|
c·10ˉ
|
|
SeO2(s)
|
24. 5
|
40. 6
|
12. 8
|
6. 1
|
|
-
|
|
C(s)
|
0
|
1. 37
|
4. 10
|
1. 02
|
-2. 10
|
298 -2300
|
|
Se(s)
|
0
|
10. 15
|
4. 53
|
5. 50
|
|
273-493
|
|
CO(g)
|
-26. 41
|
47. 18
|
6. 79
|
0. 11
|
-0. 11
|
298-2500
|
Unde: ∆H°f, 298 -
caldura de formare standard
S°f, 298 - entropia de formare standard
C°p - capacitatea calorica molara la temperatura T = 298 [ k
] si presiunea p = 1 [atm ]
∆T - interval de temperatura pe care e
valabila C°p = f ( T )
CAPITOLUL
2.
Trasformarea temperaturii de tranzitie de faza a
substantelor principale in toate scarile termodinamice abordate.
Temperaturi:
Tabel 2. Formulele scarilor
termodinamice
|
°C
|
K
|
°Re
|
°F
|
°R
|
|
1
|
273, 15
|
4/5·°C+0
|
9/5·°C+32
|
9/5·°C+491.
67
|
Unde:
°C=grade Celsius
K=grade
Kelvin
°Re=grade Reanmur
°F=grade Farenheit
°R=grade Rankin
Trasformarea
temperaturii de topire
Tabel 3. Exprimarea temperaturilor de topire ale
substantelor din reactie
|
Substanta
|
°C
|
K
|
°Re
|
°F
|
°R
|
|
SeO2(s)
|
340
|
613. 15
|
272
|
644
|
1103. 67
|
|
C(s)
|
3652
|
3925. 15
|
2921. 6
|
6605. 6
|
7065. 27
|
|
Se(s)
|
217. 4
|
490. 55
|
173. 92
|
423. 32
|
882. 99
|
|
CO(g)
|
-199
|
74. 15
|
-159. 2
|
-326. 2
|
133. 47
|
Transformarea temperaturii de
fierbere
Tabel 4. Exprimarea
temperaturilor de fierbere ale substantelor din reactie
|
Substanta
|
°C
|
K
|
°Re
|
°F
|
°R
|
|
SeO2(s)
|
|
273. 15
|
-
|
32
|
491. 67
|
|
C(s)
|
4200
|
4473. 15
|
3360
|
7592
|
8051. 67
|
|
Se(s)
|
684. 8
|
957. 95
|
547. 84
|
1264. 64
|
1724. 31
|
|
CO(g)
|
-191. 5
|
81. 65
|
-153. 2
|
-312. 7
|
146. 97
|
CAPITOLUL 3.
CALCULUL ENTALPIEI DE REACTIE IN CONDITII STANDARD:
∆H°R, 298
Entalpia de formare standard a unei substante
reprezinta cantitatea de caldura cedata sau acceptata la formarea unui mol de
substanta din element in stare standard.
Entalpia este o marime termodinamica egala cu
suma dintre energia interna a unui corp si lucrul mecanic de deslocuire a
volumului sau la o presiune constanta.
H = L+U =pV+U
Unde :
H - entalpia
U - energia interna
V - volumul molar al substantei la o presiune
constanta
P - presiunea
L - lucrul mecanic
Unitatile de
masura pentru entalpie sunt:
[ H ] = [ cal ], [ kcal ], [ kj ] , [j]
n n
∆H°R, 298 ∑ ٧i ∆H°f, p, 298 ∑٧j ∆H°f, r, 298
i=1j=1
Pentru reactia studiata:
∆H R, 298 ∑ νi, Se·∆H f, Se, 298 νi, CO·∆H f, CO, 298 ∑ νjSeO2·∆H f, SeO2, 298 νjC·∆H f, C, 298
∆H R, 298 =[(1·24. 5+2·0)-(0+2·(-26. 41)]=77. 32[kcal/mol]
∆H R, 298 =77.
32[kcal/mol]
Entalpia de reactie fiind pozitiva ∆H°r, 298>0 rezulta ca reactia este
endoterma.
APRECIERI ASUPRA STABILITATII
PARTICIPANTILOR LA REACTIE IN COMPARATIE CU ALTI COMPUSI DIN ACEEASI CLASA
Stiind ca orice sistem devine mai instabil daca
are energia de formare mare, rezulta ca substantele caracterizate de entalpie
de formare pozitiva vor fi instabile in timp ce substantele care au entalpie de
formare negative cat mai indepartate de 0 vor fi stabile.
Tabel 5. Entalpiile standard de
formare a altor compusi similari
|
Nr.
crt.
|
Substanta
|
∆H R, 298[kcal/mol]
|
|
1
|
H2SeO3
|
-126.
5
|
|
2
|
H2SeO4
|
-128.
6
|
DETERMINAREA
ECUATIEI DE DEPENDENTA A ENTALPIEI DE REACTIE IN FUNCTIE DE TEMPERATURA
Capacitatea calorica molara este cantitatea de caldura necesara unui mol
de substanta pentru a-si creste temperatura cu un grad , care are intotdeauna
valoarea pozitiva , deoarece incalzirea este un proces endoterm.
Formula
generala la substante anorganice in functie de temperatura a capacitatii calorice
molare pentru substante anorganice este:
C=a+bT+c/T²
∆HR, T ∫∆CpdT
∆HR,
T=∆a*T+∆b*T²/2-∆c*1/T+IH
IH=constanta de integrare
Unde: ∆a=∑ ٧jap-∑ ٧iar
∆b*10³=∑ ٧jbp-∑ ٧ibr
∆c*10ˉ=∑ ٧jcp-∑ ٧icr
Inlocuind
in formule vom obtine:
∆a=(1*4. 53+2*6. 79)-(1*12. 8+2*4. 10)=-2. 89
[cal/mol*k]
∆b=(1*5. 50+2*0. 11)-(1*6. 1+2*1. 02)=-2. 42*10ˉ³[cal/mol*k]
∆c=2*(-0.
11)-(2*-2. 10)=3. 98*10[cal/mol*k]
IH= ∆HR, T-∆a*T-∆b*T²/2+∆c*1/T
IH=77. 32*10³+2. 89*298+((-2. 42)*10ˉ³*298²/2 )-(3. 98*10/298)
IH=76765. 01[cal/mol]
PARTICULARIZAREA SI TRASAREA GRAFICA
A DEPENDENTEI ENTALPIEI LA TEMPERATURA DE 330K, 530K, 730K, 930K PENTRU 1 MOL
DE SUBSTANTA PRINCIPALA
Substanta
principala: SeO2
∆H°R, 330=∆H°R, 298+∆a*T│³³s298+∆b/2*T²│³³s298-∆c/T│³³s298
∆H°R, 330=77. 32*10³+[-2. 89*(330-298)]+[-2. 42*10ˉ³/2*(330²-298²)]-[3. 98*10*(1/330-1/298)]=77332. 71[cal/mol]
∆H°R, 330=77. 35[kcal/mol]
∆H°R, 530=∆H°R, 298+∆a*T│³s298+∆b/2*T²│³s298-∆c/T│³s298
∆H°R, 530=77. 32*10³+[-2. 89*(530-298)]+[-2. 42*10ˉ³/2*(530²-298²)]-[3. 98*10*(1/530-1/298)]=77. 23[kcal/mol]
∆H°R, 730=77. 32*10³+[-2. 89*(730-298)]+[-2. 42*10ˉ³/2*(730²-298²)]-[3. 98*10*(1/730-1/298)]=76. 82[kcal/mol]
∆H°R, 930=77. 32*10³+[-2. 89*(930-298)]+[-2. 42*10ˉ³/2*(930²-298²)]-[3. 98*10*(1/930-1/298)]=76. 40[kcal/mol]

Fig. 1 Entalpia de reactie pentru un mol de substanta
PARTICULARIZAREA SI TRASAREA GRAFICA
A DEPENDENTEI ENTALPIEI LA TEMPERATURA DE 330K, 530K, 730K, 930K PENTRU 200 KG
DE SUBSTANTA PRINCIPALA.
Pentru 200kg de
substanta principala: SeO2
٧ =m/M; MSeO2=79+2*16=111
٧ =200*10³/111=1801. 8 moli de SeO2
Vom inmulti rezultatele obtinute pentru un mol de
substanta cu 1801. 8:
∆H°R, 330=77. 35*1801. 8=139. 369*10³[cal]=139. 369[kcal]
∆H°R, 530=77. 23*1801. 8=139. 153[kcal]
∆H°R, 730=76. 82*1801. 8=138. 414[kcal]
∆H°R, 930=76. 40*1801. 8=137. 657[kcal]
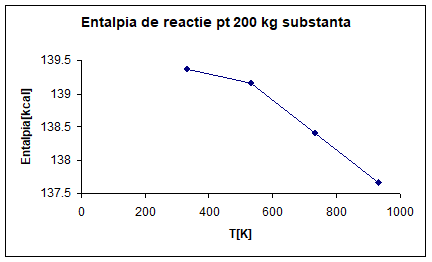
Fig 2. Entalpia de
reactie pentru 200 kg substanta
CAPITOLUL 4.
CALCULUL
ENTROPIEI DE REACTIE IN CONDITII STANDARD ∆S°R, 298
Entropia
este o functie termodinamica de stare care se ocupa cu masurarea spontaneitatii
unei transformari.
Entropia
este o marime fizica care caracterizeaza starea unui sistem fizico-chimic.
dS=dQT
Unde:
S=entropia
Q=caldura
T=temperatura
Variatia de entropie poate fi definita intr-o
reactie chimica astfel:
∆S°R, 298=∑ ٧i·∆S°f, p, 298-∑ ٧j·∆S°f, r, 298
Pt reactia studiata:
∆S R, 298 ∑ νiSer ∆S f, Se, 298 νiCOr ∆S f, CO, 298 ∑ νjSeO2· ∆S f, SeO2, 298 νj, f, C·∆S f, C, 298
Unde: νi νj -
coeficienti stoechiometrici
∆S f, p, 298-entropiile de formare a produsilor de reactie
∆S f, r, 298 entropiile de formare a reactantiilor de reactie
∆S R, 298=(1·10. 15+2· 47. 18)-(1· 40. 6+2·1.
37)=61. 17[cal/mol·K]
∆S>0 →proces posibil in
sistem izolat.
APRECIERI CALITATIVE
ASUPRA ENTROPIEI DE REACTIE IN CONDITII STANDARD
Se stie ca entropia de reactie
intr-un sistem reprezinta starea de dezordine a particulelor, ea va avea
valoare pozitiva, deoarece daca ar fi
negativa nu ar avea sens.
Entropia
unei transformari poate sa fie:
∆S>0 in sistem izolat, conditie de spontaneitate a
transformarii
∆S<0
este proces imposibil intr-un sistem izolat
∆S=0este
proces de echilibre
Atunci reactia studiata care are ∆S=61. 17>0[cal/mol*K] este
un proces posibil in sistem izolat.
APRECIERI
ASUPRA SPONTANEITATII REACTIEI
Se stie ca, conditia de spontaneitate a transformarilor in sistem izolat este aceea
ca ∆S>0, lucru demonstrat si in cazul reactiei studiate. In functie de semnul de
variatie al entalpiei si entropiei se pot face urmatoarele aprecieri asupra
regimului termic al reactiei:
1)
∆H>0 si ∆S>0 proces
spontan numai la temperaturi mari
2) ∆H>0
si∆S<0 proces imposibil
3)
∆H<0 si ∆S<0 proces
spontan la temperaturi reduse
4)
∆H<0 si∆S>0 proces
spontan la orice temperatura.
Pentru
reactia studiata avem ∆H>0 si ∆S>0 , din care va rezulta ca
procesul este spontan numai la temperaturi mari.
DETERMINAREA
ECUATIEI DE DEPENDENTA A ENTROPIEI DE REACTIE IN FUNCTIE DE TEMPERATURA
Pentru
reactia studiata vom aplica urmatoarea relatie:
∆SR, T=∆a*lnT+∆b*T-∆c*1/2*T²+IS
Unde:
IS=constanta de integrare la conditiile standard
:1[atm] si T=298K
IS= ∆S°R, 298-∆a*lnT-∆b*T+∆c*1/2*T²
IS=61. 17+2. 89*ln298+(-2. 42)*10ˉ³*298-3.
98*1/2*298²
IS=-176642. 53 [cal/mol*k]
PARTICULARIZAREA SI TRASAREA GRAFICA
A DEPENDENTEI ENTROPIEI LA TEMPERATURA DE 330K, 530K, 730K, 930K PENTRU 1 MOL
DE SUBSTANTA PRINCIPALA
Calculam:∆S°R=f(T)
Substanta
principala: SeO2
∆S°R, 330= ∆S°R, 298+ ∆a*lnT│³³s298+ ∆b*T│³³s298-1/2* ∆c/T²│³³s298
∆S°R, 330=61. 17+(-2. 89*ln(330-298))+[-2.
42*10ˉ³*(330-298)-1/2*[3. 98*10*(1/330²-1/298²)= 51. 49[cal/mol*k]
∆S°R, 530=61. 17+(-2. 86*ln530-298)+[-2.
42*10ˉ³*(530-298)]-1/2*[3. 98*10*(1/530²-1/298²)]=47. 52[cal/mol*k]
∆S°R, 730=61. 17+(-2. 86*ln730-298)+[-2. 42*10ˉ³*(730-298)]-1/2*[3. 98*10*(1/730²-1/298²)]=44. 45[cal/mol*]
∆S°R, 930=61. 17+(-2. 86*ln930-298)+[-2.
42*10ˉ³*(930-298)]-1/2*[3. 98*10*(1/930²-1/298²)]=41. 00[cal/mol*k]

Fig. 3 Entalpia de
reactie pentru un mol de substanta
PARTICULARIZAREA SI TRASAREA GRAFICA
A DEPENDENTEI ENTROPIEI LA TEMPERATURA DE 330K, 530K, 730K, 930K PENTRU 200 KG
DE SUBSTANTA PRINCIPALA. REPREZENTARE
GRAFICA.
Pentru 200kg de
substanta principala: SeO2
Vom inmulti rezultatele obtinute pentru un mol de
substanta cu 1801. 8
∆S°R, 330=51. 49*1801. 8=92. 774[kcal/K]
∆S°R, 530=47. 52*1801. 8=85. 621[kcal/K]
∆S°R, 730=44. 45*1801. 8=80. 090[kcal/K]
∆S°R, 930=41. 00*1801. 8=73. 873[kcal/K]

Fig 4. Entropia de
reactie pentru 200 kg substanta principala
CAPITOLUL 5.
CALCULUL
ENERGIEI LIBERE GIBBS:
Energia
libera Gibbs se poate calcula in functie de entalpia si entropia de reactie in
conditii standard cu urmatoarea formula:
∆G R, 298 ∆H R, 298-T ∆S R, 298
Unde
avem: ∆S°R, 298=61. 17[cal/mol*K]
∆H°R, 298=77. 32*10³[cal/mol]
T=298[k]
∆G°R, 298=77. 32*10³-298*61. 17=59.
091*10³[cal/mol]
APRECIERI ASUPRA SPONTANEITATII REACTIEI IN SISTEM IZOLAT SI NEIZOLAT
Se pot face aprecieri asupra
regimului termic al reactiei in functie de semnul de variatie al entalpiei si
entropiei procesului astfel:
∆H>0 si ∆S>0 → proces spontan la temperaturi mari
∆H>0 si ∆S<0 → proces imposibil
∆H<0 si ∆S>0→ proces spontan
la orice temperaturi
∆H<0 si ∆S<0 → proces spontan
la temperaturi reduse
Pentru reactia studiata ∆H>0 si ∆S>0 . Rezulta deci ca procesul e spontan la
temperaturi mari.
DETERMINAREA
ECUATIEI DE DEPENDENTA A ENERGIEI LIBERE GIBBS IN FUNCTIE DE TEMPERATURA
Dependenta de temperatura a energiei libere se poate determina calculand:
∆HR, T ∫∆CpdT
∆HR, T=∆a*T+∆B*T²/2-∆C*1/T+IH
∆G=-∆a*T*lnT-∆b/2*T²-∆c/2*T+IH+IG*T
IG=∆G°R, 298/T+∆a*lnT+∆b*T/2-∆c*1/2*T²-IH/T
IG=59. 091*10³/298+(-2. 89*ln298)+(-2. 42*10ˉ³*298/2)-(3.
98*10/2*298²)-76765. 01/298
IG=-78. 88[cal]
PARTICULARIZAREA SI TRASAREA GRAFICA
A DEPENDENTEI ENERGIEI LIBERE GIBBS LA TEMPERATURILE DE 330K, 530K, 730K, 930K
PENTRU 1 MOL DE SUBSTANTA PRINCIPALA.
Calculul ∆G°R, T=f(T)
Substanta
principala: SeO2
∆G°R, 330=∆H°R, 330+330*∆S°R, 330
∆G°R, 330=77. 35+330*51. 49=17. 06[kcal/mol]
∆G°R, 530=77. 23+530*47. 52=25. 26[kcal/mol]
∆G°R, 730=76. 82+730*44. 45=32. 52[cal/mol]
∆G°R, 930=76. 40+930*41. 00=38. 20[kcal/mol]

Fig 5. Energia
libera Gibbs pentru un mol de substanta
PARTICULARIZAREA SI TRASAREA GRAFICA
A DEPENDENTEI ENERGIEI LIBERE GIBBS LA TEMPERATURA DE 330K, 530K, 730K, 930K
PENTRU 200 KG DE SUBSTANTA PRINCIPALA.
Pentru 200kg de
substanta principala: SeO2
Vom inmulti rezultatele obtinute pentru un mol de
substanta cu 1801. 8
∆G°R, 330=17. 06*10³*1801. 8=307. 387*10[cal]
∆G°R, 530=25. 26*10³*1801. 8=455. 134*10[cal]
∆G°R, 730=32. 52*10³*1801. 8=585. 945*10[cal]
∆G°R, 930=38. 20*10³*1801. 8=688. 287*10[cal]
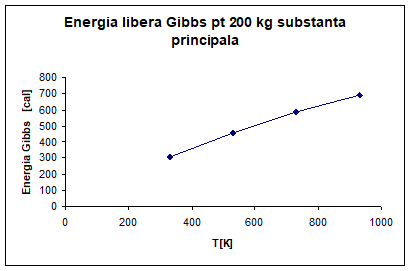
Fig 6. Energia
libera Gibbs pentru un 200 kg substanta principala
CALCULUL
AFINITATII DE REACTIE A°R, 298
Scaderea energiei libere a sistemului este egala
cu lucrul mecanic maxim reversibil pe care un sistem poate sa-l efectueze in
cadrul unei transformari.
Acest
lucru se numeste afinitate si se calculeaza cu relatiile :
A=-∆G pentru p=constant
A=-∆F pentru v=constant
∆G°R, 298=59. 091*10³[cal/mol]
Rezulta :
∆A°R, 298 =-∆G°R, 298
∆A°R, 298=-59. 091*10³[cal/mol]
Unde:
∆A°R, 298=afinitatea de reactie la
presiunea p=1[atm] si temperatura de T=298
CONCLUZII
Aceasta
analiza termodinamica ofera informatii referitoare la stabilitatea compusilor
din categoria sulfatilor, care avand entalpiile de reactie positive in conditii
standard, sunt substante instabile.
Deasemeni, in urma acestui studiu termodinamic
putem mentiona urmatoarele concluzii:
deoarece:
∆H R, T>0 rezulta ca reactia este una endoterma;
∆S R, T>0 rezulta ca procesul e spontan la
orice temperaturi in sistem izolat.
BIBLIOGRAFIE
1. Handbook of Chemistry
and Physics
2. Gavril Niac-Formule, Tabele si Probleme de
chimie fizica, editura Dacia, Cluj Napoca, 1984
3. Silvia Patachia-Curs de Chimie fizica, Reprografia
Universitatii 'Transilvania'Brasov 1994
4. Silvia Patachia-Ghid pentru realizarea si
prezentarea unui raport stiintific in chimie, Lux-Libris.







