Algoritmul de
rezolvare a problemelor la chimie
PROBLEMA 1
Stabiliti formula unui
cristalohidrat de Na2CO3 care contine 62,9345 % apa de cristalizare.
Algoritm de rezolvare
Pas1: Se scrie formula cristalohidratului
Na2CO3
∙ xH2O
Pas 2 Se calculeaza masa moleculara:
MNa2CO3 ∙
x H2O = 2 ∙ ANa + 1 ∙ AC+ 3 ∙ AO
+ x(2 ∙ AH +1 ∙ AO) = 2∙23 + 12 + 48 + 2x
+16x =106 + 18x
Pas 3: Se aplica regula de trei simpla si se determina x.
100 g
cristalohidrat(100 - 62,9345)g Na2CO3.62,9345
g H2O
106+18x g
cristalohidrat106 g Na2CO318x
g H2O
(106+18x) ∙ 62,9345 g = 100 ∙18x
x = 10, => Na2CO3 ∙ 10H2O
PROBLEMA 2
Sa se calculeze
cantitatile de zinc si acid clorhidric necesare pentru
prepararea a 13,5 l hidrogen.
Algoritm de rezolvare:
Pas
1: Se scrie
ecuatia reactiei chimice dintre Zn si HCl
Zn + 2HCl → ZnCl2
+H2↑
Pas 2 : Calcularea maselor moleculare (in grame) si volumelor moleculare (in
litri)
ale reactantilor si
produsilor de reactie. In cazul problemei date, avem:
AZn= 65 ; MHCl= 36,5 g → 2moli HCl au 73 g
MZnCl2
= 65+2∙35,5 =136 g ; MH2
=2 g → 1mol H2,in
c.n.ocupa 22,4 litri
Pas 3: Marcarea
substantelor care se iau in calcul :
Zn + 2HCl →
ZnCl2 + H2↑
Pas 4: Sub
substantele marcate se noteaza masa si volumul molar.
Pas 5: Zn si
HCl se noteaza cu x si y.
x y 13,5 l
Zn + 2HCl
→ ZnCl2 + H2
↑
65g 73g 22,4 l
Pas 6: Din
proportiile astfel obtinute, se calculeaza necunoscutele.
 =
=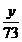 =
= 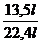
 x =
x = 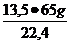 = 39,17g Zn
= 39,17g Zn
y = 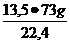 = 44 g HCl
= 44 g HCl
PROBLEMA 3
Calculati
concentratia unei solutii de NaCl stiind ca in 500g
apa se gasesc 60,23∙1023
ioni de Na+.
Algoritm de rezolvare
Pas 1: Se scrie formula
concentratiei procentuale.
c =  ∙ 100 =
∙ 100 = 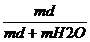
 ∙100
∙100
Pas 2: Se calculeaza masa
moleculara a NaCl.
MNaCl= 1 ∙
ANa + 1 ∙ ACl = 23 +35,5= 58,5 g
Pas 3: Se aplica regula de trei
simpla in functie de numarul lui Avogadro pentru a afla
md.
In 58,5 g NaCl
6,023∙1023 ioni Na+
md g NaCl
60,23∙1023ioni Na+
md =
585 g NaCl
Pas 4: Se calculeaza c%:
ms = md
+ mH2O = 585g+ 500g= 1085g
c% = 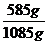 ∙100= 53,92%
∙100= 53,92%
PROBLEMA 4
Calculati
procentul de calciu dintr-un amestec de CaO si Ca(OH)2 in
raport 1/2.
Algoritm de rezolvare
Pas 1: Se
scriu formulele componentilor amestecului:
CaO Ca(OH)2
Pas 2: Se
calculeaza masele moleculare pentru componenti.
MCaO =
1∙ACa +1∙AO= 40+16=56g
MCa(OH)2
= 1∙ACa+2∙AO+ 2∙AH = 40+ 32+
2 = 74g
Pas 3: Se
considera ca amestecul contine 1mol CaO si 2moli Ca(OH)2.
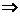 1 mol CaO .56g CaO in care se
gasesc 40 g
Ca
1 mol CaO .56g CaO in care se
gasesc 40 g
Ca
2 moli Ca(OH)2..148g
Ca(OH)2 in care se gasesc 80 g Ca
Pas 4: Se
calculeaza masa amestecului:
mam.= 56g+148g =204g amestec
CaO si Ca(OH)2
Pas 5: Se
aplica regula de trei simpla si se determina cantitatea de
Ca din 1oog amestec.
In 204g
amestec..(40+80)g Ca
100g
amestec..p
p= = 58,82%Ca
= 58,82%Ca
PROBLEMA 5
Se
dau 300 cm3 solutie de acid azotic 30%,cu densitatea 1,18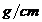 3 si
3 si
500cm3
solutie de acid azotic 50%,cu densitatea 1,32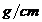 3.Sa se afle concentratia
procentuala a solutiei obtinuta dupa amestecarea celor
doua solutii
3.Sa se afle concentratia
procentuala a solutiei obtinuta dupa amestecarea celor
doua solutii
initiale.
Algoritm de rezolvare:
Pas1: Se
scrie formula densitatii solutiei:

Pas 2: Se calculeaza masele
solutiilor din amestec:
ms1 = ρ1∙V1
= 1,18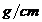 3∙300cm3 =354g sol.HNO3
30%
3∙300cm3 =354g sol.HNO3
30%
ms2 = ρ2∙V2
= 1,32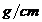 3∙ 500cm3 = 660 g sol.HNO3 50%
3∙ 500cm3 = 660 g sol.HNO3 50%
Pas 3 Se scrie
formula concentratiei procentuale pentru fiecare solutie:
c1 =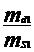 ∙100 , c2
=
∙100 , c2
= ∙ 100
∙ 100
Pas 4: Se
calculeaza md1 si md2:
md1 =  =
= 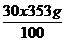 = 106,2 g HNO3
= 106,2 g HNO3
md2 =  =
= 
 = 330g HNO3
= 330g HNO3
Pas 5: Se
calculeaza masa de substanta dizolvata si masa
totala a solutiei finale:
md = md1 + md2
= 106,2g+ 330g = 436,2g
mS = mS1
+ mS2 = 354g +660g = 1014g
Pas 6: Se
calculeaza concentratia procentuala a solutiei finale:
C = =
=  = 43%
= 43%


 =
=